曾工致力于各类电子电器产品的国际国内认证、EMC整改,欢迎各位询价,提供专业服务,解决客户痛点!专治各种产品不合格!
电话:139 2899 3907 邮箱:info@emc.wiki
“Mask Certification”的版本间差异
来自认证百科
| 第29行: | 第29行: | ||
注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。 | 注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。 | ||
==欧盟医用口罩新版MDR指令(医疗器械)== | |||
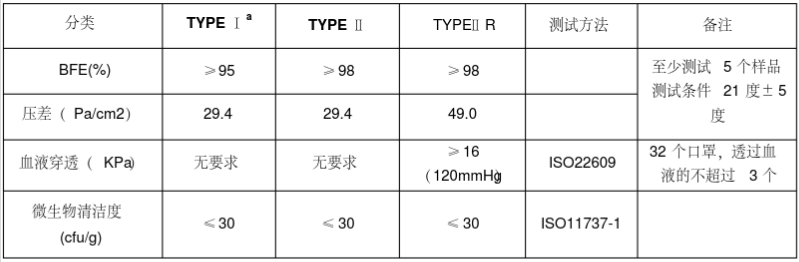
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。口罩在欧盟属于I类器械,但是分为I类非无菌和无菌两种。 | |||
[[文件:EN14683.png|799x262px|无框]] | |||
1.非无菌口罩(现阶段只有这种可行) | |||
1)编制技术文件 | |||
2)提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告) | |||
3)提供符合性声明 | |||
4)指定欧盟授权代表完成欧洲注册 | |||
时间估计:2-3个月 | |||
2.无菌口罩(现阶段新版MDR实施难度很大) | |||
1)灭菌确认 | |||
2)ISO13485体系认证 | |||
3)编制技术文件 | |||
4)提供测试报告(生物学、性能、无菌等测试报告) | |||
5)公告机构审核(目前几乎没有公告机构愿意接单) | |||
6)获得CE证书 | |||
7)指定欧盟授权代表完成欧洲注册 | |||
时间估计:1-2年,因此今年几乎是不可能了! | |||
2020年3月22日 (日) 10:14的版本
口罩认证
欧盟口罩认证
- 欧盟个人防护口罩(非医疗器械)
- 欧盟医用口罩(医疗器械)
北美口罩认证
- 美国FDA注册医用口罩
- 美国NIOSH认证防护口罩
欧盟个人防护口罩PPE指令(非医疗器械)
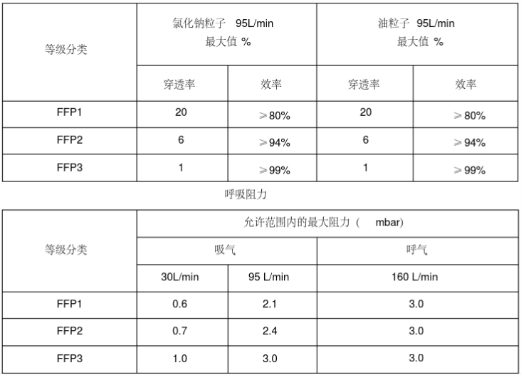
欧盟个人防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。
主流的防护口罩为FFP2/FFP3两大类。
认证流程:
1. 产品的型式试验报告
2. 技术文件评审
3. 工厂质量体系审查
4. 颁发CE证书
5. 产品出口
注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。
欧盟医用口罩新版MDR指令(医疗器械)
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。口罩在欧盟属于I类器械,但是分为I类非无菌和无菌两种。
1.非无菌口罩(现阶段只有这种可行) 1)编制技术文件 2)提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告) 3)提供符合性声明 4)指定欧盟授权代表完成欧洲注册 时间估计:2-3个月
2.无菌口罩(现阶段新版MDR实施难度很大) 1)灭菌确认 2)ISO13485体系认证 3)编制技术文件 4)提供测试报告(生物学、性能、无菌等测试报告) 5)公告机构审核(目前几乎没有公告机构愿意接单) 6)获得CE证书 7)指定欧盟授权代表完成欧洲注册 时间估计:1-2年,因此今年几乎是不可能了!