曾工致力于各类电子电器产品的国际国内认证、EMC整改,欢迎各位询价,提供专业服务,解决客户痛点!专治各种产品不合格!
电话:139 2899 3907 邮箱:info@emc.wiki
“Mask Certification”的版本间差异
(→认证流程) |
(→日本口罩认证) |
||
| (未显示同一用户的55个中间版本) | |||
| 第10行: | 第10行: | ||
=欧盟个人防护口罩PPE指令(非医疗器械)= | =欧盟个人防护口罩PPE指令(非医疗器械)= | ||
==欧盟个人防护口罩标准== | |||
欧盟个人防护口罩的欧洲标准是'''EN149及EN143 | |||
==欧盟个人防护口罩分类== | |||
按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。 | |||
主流的防护口罩为FFP2/FFP3两大类。 | 主流的防护口罩为FFP2/FFP3两大类。 | ||
| 第17行: | 第22行: | ||
==认证流程== | ==认证流程== | ||
1. 申请 | |||
* 填写申请表 | |||
* 申请公司信息表 | |||
* 提供产品资料并寄样 | |||
2. 报价 | |||
根据所提供的资料工程师确定测试标准,测试时间及相应费用 | |||
3. 付款 | |||
申请人确认报价后,签订立案申请表及服务协议并支付款项 | |||
4. 测试,产品的型式试验报告 | |||
实验室根据相关的欧盟检测标准对所申请产品进行全套测试 | |||
5. CE技术文档评审,测试通过,报告完成 | |||
6. 工厂质量体系审查(ISO9001) | |||
# | 7. 颁发CE证书 | ||
8. 产品出口 | |||
==检测项目== | |||
口罩CE认证标准EN 149-2001+A1-2009检测项目 | |||
# 外观 | |||
# 材料 | |||
# 阻然测试 | |||
# 头带 | |||
# 呼气阀 | |||
# 预处理 | |||
# 呼吸阻力 | |||
# 漏气系数 | |||
# 二氧化碳浓度 | |||
# 实际配戴 | |||
==认证注意事项== | |||
必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。 | |||
需要确认PPE指令的NB机构资质,防止没有PPE指令的发假证。 | |||
==认证周期== | ==认证周期== | ||
| 第33行: | 第66行: | ||
=欧盟医用口罩新版MDR指令(医疗器械)= | =欧盟医用口罩新版MDR指令(医疗器械)= | ||
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/ | 医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。 | ||
==欧盟医用口罩分类== | |||
口罩在欧盟可以按照I类器械管理,分为: | |||
# 非无菌 | |||
# 无菌 | |||
依据产品是无菌或非无菌状态提供,认证模式有所差别。 | |||
[[文件:EN14683.png|799x262px|无框]] | [[文件:EN14683.png|799x262px|无框]] | ||
| 第45行: | 第85行: | ||
===认证周期=== | ===认证周期=== | ||
时间预估:2-3个月 | |||
==无菌口罩(现阶段新版MDR实施难度很大)== | ==无菌口罩(现阶段新版MDR实施难度很大)== | ||
| 第67行: | 第107行: | ||
# 生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个) | # 生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个) | ||
=美国NIOSH认证防护口罩(非医疗器械)= | |||
==美国防颗粒口罩分类== | ==欧盟医疗指令NB机构查询== | ||
===MDR公告机构=== | |||
'''Regulation (EU) 2017/745 [[Notified_Body|MDR Bodies]]''' | |||
[[文件:Regulation (EU) 2017-745 MDR Bodies.PNG|907x564px|无框]] | |||
===更多NB公告机构查询=== | |||
例如,MDD的NB公告机构 | |||
https://www.emc.wiki/thread-4185-1-1.html | |||
==更多NB机构查询== | |||
Refer to below website: | |||
https://www.emc.wiki/thread-4186-1-1.html | |||
https://www.emc.wiki/thread-4185-1-1.html | |||
=北美口罩认证= | |||
==美国NIOSH认证防护口罩(非医疗器械)== | |||
===美国防颗粒口罩分类=== | |||
防护口罩需要获得NIOSH(美国国家职业安全卫生研究所)认证。 | 防护口罩需要获得NIOSH(美国国家职业安全卫生研究所)认证。 | ||
| 第82行: | 第143行: | ||
# P100 | # P100 | ||
==美国口罩按过滤网材质分类== | ===美国口罩按过滤网材质分类=== | ||
按过滤网材质的最低过滤效率,可将口罩分为三种等级:N ,R ,P | 按过滤网材质的最低过滤效率,可将口罩分为三种等级:N ,R ,P | ||
# N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。 | # N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。 | ||
| 第88行: | 第149行: | ||
# P类的口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。 | # P类的口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。 | ||
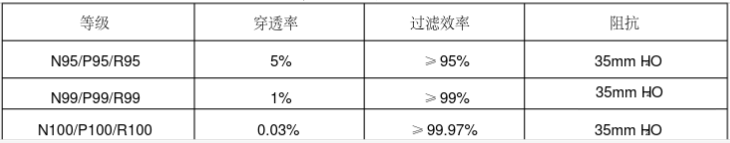
==美国NIOSH对防颗粒物口罩分类== | ===美国NIOSH对防颗粒物口罩分类=== | ||
[[文件:美国防颗粒口罩分类.PNG|630x230px|无框]] | [[文件:美国防颗粒口罩分类.PNG|630x230px|无框]] | ||
NIOSH认证系列口罩需符合42 CFR Part 84的要求,测试指标包括呼气阻力测试(Exhalation Resistance Test)、呼气阀泄漏测试(Exhalation Valve Leakage Test)、吸气阻力测试(Inhalation Resistance Test)、过滤效率测试(Sodium Chloride Test)等。 | NIOSH认证系列口罩需符合42 CFR Part 84的要求,测试指标包括呼气阻力测试(Exhalation Resistance Test)、呼气阀泄漏测试(Exhalation Valve Leakage Test)、吸气阻力测试(Inhalation Resistance Test)、过滤效率测试(Sodium Chloride Test)等。 | ||
==美国阻尘口罩标准== | ===美国阻尘口罩标准=== | ||
NIOSH Standard(Title 42 CFR Part 84) | NIOSH Standard(Title 42 CFR Part 84) | ||
[[文件:Title 42 CFR Part 84.png|730x143px|无框]] | [[文件:Title 42 CFR Part 84.png|730x143px|无框]] | ||
==认证周期== | ===认证流程=== | ||
按照美国FDA医疗I类做认证,流程为: | |||
# 填写申请表格,信息确认 | |||
# 获取PIN码,交付年费 | |||
# 下发注册号 | |||
# 产品出口 | |||
===认证周期=== | |||
理论时间估计:2-3个月 | |||
最近疫情期间大家扎堆在做注册,各种排队的时间肯定会越来越长,排期可能要8-12个月或更久。 | |||
=美国FDA注册医用口罩(医疗器械)= | ==美国FDA注册医用口罩(医疗器械)== | ||
常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ儿科口罩和OUK带抗菌/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。 | 常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ儿科口罩和OUK带抗菌/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。 | ||
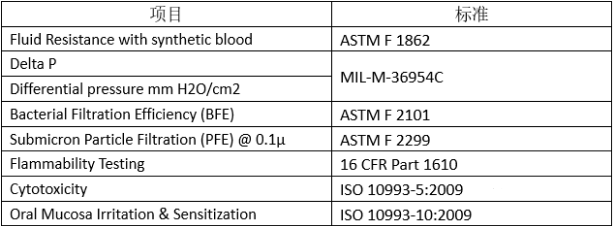
== | ===口罩必须满足ASTM测试标准=== | ||
[[文件:ASTM-1.png|613x226px|无框]] | |||
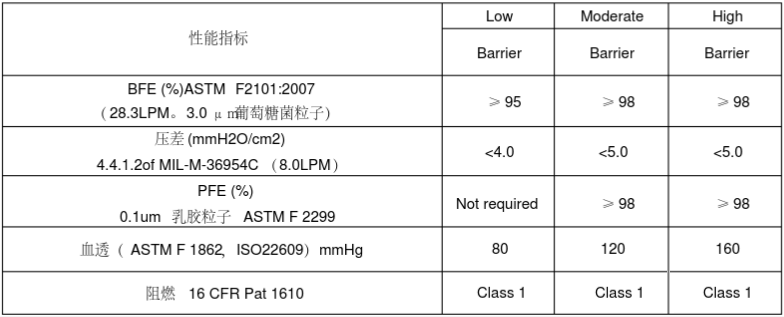
ASTM F2100-2004(医疗口罩材料) | |||
[[文件:ASTM F2100-2004.png|784x317px|无框]] | |||
===认证流程=== | |||
按照美国FDA医疗II类做认证,流程为: | |||
510k申请流程 | |||
# 进行产品测试(性能测试、生物学测试) | |||
# 准备510k技术文件,提交FDA审评 | |||
# 获得FDA的510k批准信 | |||
# 完成工厂注册和器械列名 | |||
# 产品出口 | |||
注意:如已从官方途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k | 注意:如已从官方途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k | ||
== | ===认证周期=== | ||
时间估计:6-10个月 | |||
最近疫情期间大家扎堆在做注册,各种排队的时间肯定会越来越长,排期可能要8-12个月或更久。 | |||
==美国医用N95及以上9种口罩认证要求== | |||
认证的申请需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系资料)至NIOSH进行文件审核,只有文件审核和产品测试都通过,NIOSH才会核发认证。具体的认证则由NIOSH下属的NPPTL实验室操作。 | |||
=韩国医用口罩认证= | |||
韩国的口罩标准KF (Korean filter) 系列,是由韩国的食品药品管理部门 (Ministry of Food and Drug Safety,MFDS) 发布的韩国主流口罩标准 (Regulations on the Approval,Notification,and Evaluation of Quasi-Drugs) 。 | |||
=日本口罩认证= | |||
日本JIST81512018标准是呼吸保护装置的标准,也是日本厚生劳动省 (MHLW) 验证标准,出口日本需要做此认证。 | |||
= | =美国疾病控制与预防中心(CDC)发布优化N95口罩供应策略= | ||
https://www.emc.wiki/thread-4189-1-1.html | |||
2020年3月24日 (二) 18:26的最新版本
口罩认证
欧盟口罩认证
- 欧盟个人防护口罩(非医疗器械)
- 欧盟医用口罩(医疗器械)
北美口罩认证
- 美国FDA注册医用口罩
- 美国NIOSH认证防护口罩
欧盟个人防护口罩PPE指令(非医疗器械)
欧盟个人防护口罩标准
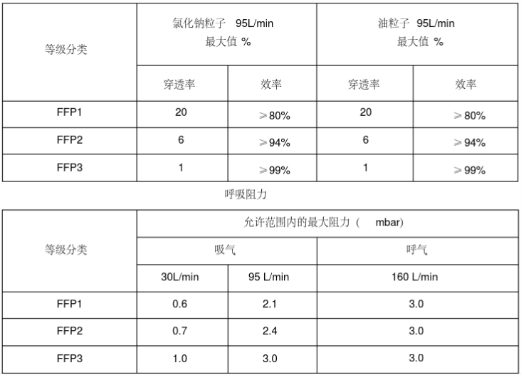
欧盟个人防护口罩的欧洲标准是EN149及EN143
欧盟个人防护口罩分类
按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。
主流的防护口罩为FFP2/FFP3两大类。
认证流程
1. 申请
- 填写申请表
- 申请公司信息表
- 提供产品资料并寄样
2. 报价 根据所提供的资料工程师确定测试标准,测试时间及相应费用
3. 付款 申请人确认报价后,签订立案申请表及服务协议并支付款项
4. 测试,产品的型式试验报告 实验室根据相关的欧盟检测标准对所申请产品进行全套测试
5. CE技术文档评审,测试通过,报告完成
6. 工厂质量体系审查(ISO9001)
7. 颁发CE证书
8. 产品出口
检测项目
口罩CE认证标准EN 149-2001+A1-2009检测项目
- 外观
- 材料
- 阻然测试
- 头带
- 呼气阀
- 预处理
- 呼吸阻力
- 漏气系数
- 二氧化碳浓度
- 实际配戴
认证注意事项
必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。
需要确认PPE指令的NB机构资质,防止没有PPE指令的发假证。
认证周期
预计1个月之内
欧盟医用口罩新版MDR指令(医疗器械)
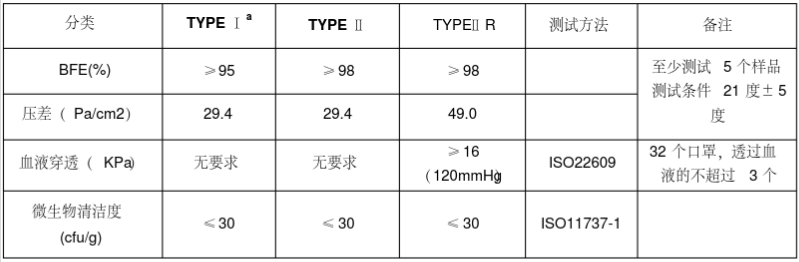
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。
欧盟医用口罩分类
口罩在欧盟可以按照I类器械管理,分为:
- 非无菌
- 无菌
依据产品是无菌或非无菌状态提供,认证模式有所差别。
非无菌口罩(现阶段只有这种可行)
认证流程
- 编制技术文件
- 提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告)
- 提供符合性声明
- 指定欧盟授权代表完成欧洲注册
认证周期
时间预估:2-3个月
无菌口罩(现阶段新版MDR实施难度很大)
认证流程
- 灭菌确认
- ISO13485体系认证
- 编制技术文件
- 提供测试报告(生物学、性能、无菌等测试报告)
- 公告机构审核(目前几乎没有公告机构愿意接单)
- 获得CE证书
- 指定欧盟授权代表完成欧洲注册
认证周期
时间估计:1-2年,因此今年几乎是不可能了!
检测标准
- 生物学评价:ISO10993-1,ISO10993-5,ISO10993-10(常规三项)
- 细菌过滤效率:EN 14683:2019附录B
- 呼吸阻抗:EN 14683:2019的附录C
- 防溅阻力:ISO 22609:2004
- 生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个)
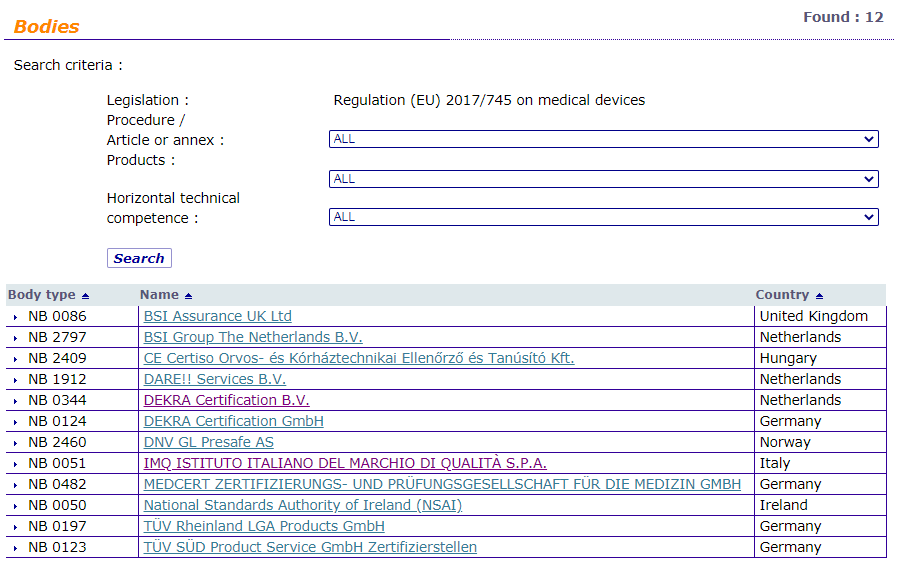
欧盟医疗指令NB机构查询
MDR公告机构
Regulation (EU) 2017/745 MDR Bodies
更多NB公告机构查询
例如,MDD的NB公告机构
https://www.emc.wiki/thread-4185-1-1.html
更多NB机构查询
Refer to below website:
https://www.emc.wiki/thread-4186-1-1.html
https://www.emc.wiki/thread-4185-1-1.html
北美口罩认证
美国NIOSH认证防护口罩(非医疗器械)
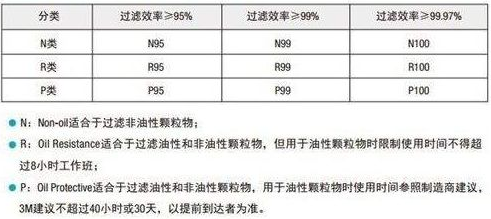
美国防颗粒口罩分类
防护口罩需要获得NIOSH(美国国家职业安全卫生研究所)认证。
按照过滤效率美国防颗粒口罩分类可分成如下9个类别:
- N95
- N99
- N100
- R95
- R99
- R100
- P95
- P99
- P100
美国口罩按过滤网材质分类
按过滤网材质的最低过滤效率,可将口罩分为三种等级:N ,R ,P
- N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。
- R类的口罩只适合过滤油性颗粒物及非油性颗粒物,但用于油性颗粒物时限制使用时间不得超过8小时。
- P类的口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。
美国NIOSH对防颗粒物口罩分类
NIOSH认证系列口罩需符合42 CFR Part 84的要求,测试指标包括呼气阻力测试(Exhalation Resistance Test)、呼气阀泄漏测试(Exhalation Valve Leakage Test)、吸气阻力测试(Inhalation Resistance Test)、过滤效率测试(Sodium Chloride Test)等。
美国阻尘口罩标准
NIOSH Standard(Title 42 CFR Part 84)
认证流程
按照美国FDA医疗I类做认证,流程为:
- 填写申请表格,信息确认
- 获取PIN码,交付年费
- 下发注册号
- 产品出口
认证周期
理论时间估计:2-3个月
最近疫情期间大家扎堆在做注册,各种排队的时间肯定会越来越长,排期可能要8-12个月或更久。
美国FDA注册医用口罩(医疗器械)
常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ儿科口罩和OUK带抗菌/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。
口罩必须满足ASTM测试标准
ASTM F2100-2004(医疗口罩材料)
认证流程
按照美国FDA医疗II类做认证,流程为:
510k申请流程
- 进行产品测试(性能测试、生物学测试)
- 准备510k技术文件,提交FDA审评
- 获得FDA的510k批准信
- 完成工厂注册和器械列名
- 产品出口
注意:如已从官方途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k
认证周期
时间估计:6-10个月
最近疫情期间大家扎堆在做注册,各种排队的时间肯定会越来越长,排期可能要8-12个月或更久。
美国医用N95及以上9种口罩认证要求
认证的申请需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系资料)至NIOSH进行文件审核,只有文件审核和产品测试都通过,NIOSH才会核发认证。具体的认证则由NIOSH下属的NPPTL实验室操作。
韩国医用口罩认证
韩国的口罩标准KF (Korean filter) 系列,是由韩国的食品药品管理部门 (Ministry of Food and Drug Safety,MFDS) 发布的韩国主流口罩标准 (Regulations on the Approval,Notification,and Evaluation of Quasi-Drugs) 。
日本口罩认证
日本JIST81512018标准是呼吸保护装置的标准,也是日本厚生劳动省 (MHLW) 验证标准,出口日本需要做此认证。